
Aktinyum Tedavisi: Kimlere Uygulanır, Süreç Nasıldır?
Aktinyum tedavisi, kanser hücrelerini seçici biçimde hedefleyen “hedefli radionüklid tedaviler” ailesinin alfa parçacığı yayan üyelerinden biridir. Bu yaklaşımda amaç, radyoaktif bir çekirdeği tümör hücresinin üzerinde bulunan bir hedefe bağlayıp ilacı kan dolaşımıyla tümör odaklarına ulaştırmaktır. [2]
- Aktinyum tedavisi nedir?
- Aktinyum-225 ve hedefli alfa tedavisi nasıl çalışır?
- Lutesyum ile Aktinyum tedavisi farkları
- Aktinyum tedavisi hangi hastalıklarda kullanılır?
- Aktinyum tedavisi kimlere uygun olabilir?
- Tedavi öncesi değerlendirme ve hazırlık
- Aktinyum tedavisi nasıl uygulanır?
- Tedavi sonrası takip ve günlük yaşam
- Yan etkiler ve olası riskler
- Yan etkileri azaltmaya yönelik pratik stratejiler
- Tedavinin etkinliğine dair bilimsel veriler nasıl okunmalı?
- Tedavi planlamasında pratik başlıklar
- Aktinyum tedavisi öncesi hedef görüntüleme ve dozimetri
- Kimlerde dikkatli olunmalı veya ertelenebilir?
- Takipte hangi görüntüleme yöntemleri kullanılır?
- Aktinyum tedavisi ve yaşam kalitesi: Beklentiyi doğru kurmak
- Sıkça sorulan sorular
- Aktinyum tedavisi hakkında akılda kalması gerekenler
- Kaynaklar
Son yıllarda özellikle ileri evre prostat kanseri ve bazı nöroendokrin tümörlerde, klasik tedavilere yanıtın sınırlı kaldığı durumlar için Aktinyum tedavisi daha sık gündeme gelmektedir. Yöntem hâlâ birçok ülkede sınırlı merkezlerde ve seçilmiş hastalarda uygulanabildiğinden, süreç genellikle ayrıntılı değerlendirme ve yakın takip gerektirir. [5]
Aktinyum tedavisi nedir?
Aktinyum tedavisi, radyoaktif aktinyum-225 izotopunun, kanser hücresini tanıyan bir “taşıyıcı molekül” ile birleştirilmesiyle oluşturulan hedefli bir tedavi yaklaşımıdır. Tedavi damardan uygulanır ve ilaç dolaşım aracılığıyla hedefi taşıyan tümör hücrelerine tutunmaya çalışır. [2]
Aktinyum-225’in yaydığı alfa parçacıkları çok kısa mesafede yüksek enerji bırakır. Bu özellik, radyasyon etkisinin daha çok hedef hücre ve hemen çevresindeki çok küçük bir alanda yoğunlaşmasını sağlar. [3]
Bu tedavi, kemoterapinin tüm vücuda yayılan etkisinden veya dışarıdan verilen klasik radyoterapinin alan sınırlamasından farklı bir mantıkla çalışır. Hedef uygun seçildiğinde, sistemik dolaşım üzerinden çok sayıda metastaz odağına aynı anda ulaşabilme avantajı doğabilir. [2]
Aktinyum-225 ve hedefli alfa tedavisi nasıl çalışır?
Alfa parçacıklarıyla hücre içi hasar mekanizması
Alfa parçacıkları (helyum çekirdeği), kısa menzilde yüksek “doğrusal enerji aktarımı” yapar. Bu, hücre DNA’sında onarımı zor çift zincir kırıkları gibi ağır hasarlar oluşturabilmesiyle ilişkilendirilir. [3]
Alfa tedavisinin en önemli pratik sonucu, etki alanının mikrometre düzeyinde kalmasıdır. Literatürde alfa parçacıklarının doku içindeki menzili yaklaşık 40–100 mikrometre olarak verilir; beta yayıcıların menzili ise milimetreler düzeyinde daha uzundur. [3]
Kısacası, aynı hedefe bağlanan iki farklı radyonüklidden alfa yayıcı olanın ‘daha yakın mesafede daha yoğun’ etki bırakma eğilimi vardır. Bu nedenle bazı dirençli olgularda alfa tedavisi araştırılmaktadır. [3]
Hedef molekül ne işe yarar? PSMA ve somatostatin reseptörü örnekleri
Aktinyum-225 tek başına ‘nereye gideceğini’ bilmez. Bu yüzden izotop, tümör hücresinde fazla bulunan bir hedefe bağlanabilen moleküle tutturulur. Prostat kanserinde sık kullanılan hedeflerden biri PSMA adı verilen yüzey proteinidir; nöroendokrin tümörlerde ise somatostatin reseptörleri öne çıkar. [6]
Bu hedeflerin uygunluğu, genellikle hedefi gösteren nükleer tıp görüntülemeleriyle değerlendirilir. Örneğin prostat kanserinde PSMA hedefi, nöroendokrin tümörlerde somatostatin reseptör hedefi ‘tutulum’ üzerinden incelenebilir. Hedef yeterli değilse, ilacın tümör yerine normal dokuda birikme riski artabileceğinden tedavi planı yeniden gözden geçirilir. [6] [8]
Aktinyum-225’in temel özellikleri
Aktinyum-225’in fiziksel yarı ömrü yaklaşık 9,92 gündür. Bu yarı ömür, hedef molekülle bağlanan izotopun tümör odaklarında bir süre kalıp etki bırakabilmesi açısından pratik bir aralık olarak değerlendirilir. [1]
Aktinyum-225 bozunma zinciri boyunca birden fazla alfa yayımı içerir. Teorik olarak bu, tek bir bağlanma olayından sonra ‘art arda’ yüksek enerjili parçacık etkileri oluşmasına katkı sağlayabilir. [1]
Bununla birlikte aktinyum-225 ile yapılan tedavilerin hâlâ standartlaşma sürecinde olduğunu bilmek önemlidir. Doz, kür sayısı ve aralıklar; tümör tipi, önceki tedaviler, böbrek-kemik iliği rezervi ve hedef tutulumuna göre bireyselleştirilir. [5] [7]
Lutesyum ile Aktinyum tedavisi farkları
Hedefli radionüklid tedavilerde ‘hangi izotopun’ seçileceği, sadece güç meselesi değildir. Işın türü, doku menzili, yan etki deseni ve klinik kanıt düzeyi gibi pek çok başlık birlikte değerlendirilir. [3] [6]
| Karşılaştırma başlığı | Lutesyum-177 odaklı tedaviler | Aktinyum-225 odaklı tedaviler |
| Yayılan parçacık | Beta parçacığı (daha uzun menzil) | Alfa parçacığı (çok kısa menzil) [3] |
| Doku içi menzil | Yaklaşık 2–12 mm [3] | Yaklaşık 40–100 µm [3] |
| DNA hasarı eğilimi | Daha düşük LET, daha ‘yaygın’ etki [3] | Daha yüksek LET, daha ‘yoğun’ etki [3] |
| Kanıt düzeyi | Bazı endikasyonlarda daha yerleşik kılavuzlar [6] [8] | Birçok alanda daha çok çalışma/deneyim birikiyor [5] [7] |
| Uygulama mantığı | Hedefe bağlanan beta yayıcı radyoligand/peptit [6] [8] | Hedefe bağlanan alfa yayıcı radyoligand/peptit [5] [7] |
Pratikte birçok merkez, önce daha yerleşik kanıtı olan beta yayıcı protokollerle ilerler. Alfa tedavisi ise seçilmiş olgularda, özellikle direnç geliştiğinde veya klinik araştırma kapsamında gündeme gelebilir. [5] [6]
Aktinyum tedavisi hangi hastalıklarda kullanılır?
Aktinyum tedavisi en çok iki hastalık grubunda konuşulur: ileri evre prostat kanseri ve somatostatin reseptörü hedefli bazı nöroendokrin tümörler. Ancak her iki alanda da hasta seçimi oldukça kritiktir ve tedavi çoğu zaman çok disiplinli bir ekip kararıyla planlanır. [6] [8]
İleri evre prostat kanserinde kullanım alanı
Prostat kanserinde hedefli tedaviler, özellikle metastatik ve hormon baskılayıcı tedavilere rağmen ilerleyen tabloda önem kazanır. PSMA hedefi pozitif olan hastalarda radionüklid tedaviler, standart sistemik tedavilere ek veya sonraki basamaklarda değerlendirilebilir. [6]
Aktinyum-225 ile PSMA hedefli alfa tedavisine dair ilk klinik deneyimler, seçilmiş ileri evre hastalarda iki ay arayla kilo başına 100 kBq gibi dozların kullanıldığı protokoller üzerinden raporlanmıştır. [4]
Daha geniş bir retrospektif seride hastalara iki ay arayla üç kür uygulanan bir protokolde, 8 hafta yaşayabilen hastaların %63’ünde PSA değerinde %50’den fazla düşüş bildirilmiştir. Aynı seride herhangi bir derecede PSA yanıtı %87 olarak raporlanmıştır. [5]
Bu veriler umut verici olsa da, hastaların önceki tedavi yükü, tümör biyolojisi ve yan etki toleransı gibi değişkenler sonuçları güçlü biçimde etkileyebilir. Bu nedenle her hasta için ‘beklenen yarar’ net bir garanti olarak düşünülmemelidir. [5] [6]
Nöroendokrin tümörlerde kullanım alanı
Nöroendokrin tümörlerde hedef genellikle somatostatin reseptörleridir. Beta yayıcı PRRT protokolleri için yayınlanmış prosedür standartları bulunur ve birçok ülkede belirli endikasyonlarda daha yerleşik uygulamalar söz konusudur. [8] [9]
Aktinyum-225 ile hedefli alfa yaklaşımı ise çoğunlukla, beta yayıcı PRRT’ye direnç gelişmiş veya önceki kür sınırına ulaşmış hastalarda ‘kurtarma’ ya da araştırma amaçlı seçenek olarak ele alınır. [7]
Prospektif bir çalışmada, metastatik gastroenteropankreatik nöroendokrin tümörlü hastalara 8 hafta arayla kilo başına 100 kBq aktinyum-225 temelli alfa tedavisi uygulanmış; değerlendirilebilen 24 hastanın 15’inde parsiyel yanıt, 9’unda stabil hastalık raporlanmıştır. [7]
Daha küçük bir prospektif seride ise görüntüleme temelli hastalık kontrol oranı %80 olarak bildirilmiştir. Aynı çalışmada ciddi (III/IV derece) kan, böbrek veya karaciğer toksisitesi gözlenmediği belirtilmiştir. [10]
Diğer alanlar: Neden ‘araştırma aşaması’ vurgulanıyor?
Hedefli alfa tedaviler, farklı tümör hedeflerine yönelik pek çok klinik çalışmada değerlendirilmektedir. Bu çeşitlilik, yöntemin potansiyelini gösterse de aynı zamanda standart protokollerin henüz her alanda oturmadığı anlamına gelir. [1] [3]
Bu nedenle bir merkez ‘aktinyum tedavisi yapıyoruz’ dediğinde, hangi hedef molekülle, hangi doz-kür aralığıyla, hangi endikasyonla ve hangi izlem protokolüyle uygulandığı mutlaka netleştirilmelidir. [6] [8]
Aktinyum tedavisi kimlere uygun olabilir?
Adaylık değerlendirmesi, yalnızca tümör tanısıyla sınırlı değildir. Hedefin görüntülemede yeterli olması, organ fonksiyonlarının tedaviyi kaldırabilecek düzeyde bulunması ve önceki tedavilerin toplam yükü birlikte ele alınır. [6] [8]
Sık kullanılan uygunluk başlıkları aşağıdaki gibidir:
- Hedef pozitifliği: Prostat kanserinde PSMA, nöroendokrin tümörlerde somatostatin reseptör tutulumunun görüntüleme ile gösterilmesi. [6] [8]
- Böbrek fonksiyonları: Radionüklid tedavilerde böbreklerin izlenmesi önemlidir; sınır değerler kılavuzlara göre değişebilir. [8] [9]
- Kemik iliği rezervi: Hemoglobin, lökosit ve trombosit düzeyleri tedavi planında belirleyicidir. [8]
- Genel durum ve eşlik eden hastalıklar: Günlük yaşam aktiviteleri, kilo kaybı, enfeksiyon öyküsü gibi etkenler risk değerlendirmesine girer. [6]
- Önceki tedaviler: Hangi basamaklarda hangi tedavilerin alındığı, aktinyum yaklaşımının ‘ne zaman’ düşünüleceğini etkiler. [5] [6]
Bu maddeler bir ‘eleme listesi’ değildir; daha çok hekimlerin risk-yarar dengesini sayısallaştırmasına yarayan çerçevelerdir. Nihai karar, kişinin klinik tablosu ve merkez uygulama protokolüyle birlikte verilir. [6] [8]
Tedavi öncesi değerlendirme ve hazırlık
Aktinyum tedavisi planlanmadan önce hedefin görüntüleme ile doğrulanması ve temel laboratuvar testlerinin yapılması beklenir. Nöroendokrin tümörlerde yayınlanmış prosedür standardı; böbrek fonksiyonları, karaciğer enzimleri ve tam kan sayımı gibi değerlerin her kür öncesinde kontrol edilmesini önerir. [8]
Aynı prosedürde, laboratuvarların çoğu merkezde her kürden yaklaşık 2 hafta önce kontrol edilmesi yaygın bir pratik olarak belirtilir. Bu yaklaşım, ilaç hazırlanırken güvenlik payı oluşturmayı amaçlar. [8]
Prostat kanseri için yayınlanmış ortak kılavuzlar da benzer şekilde hasta seçiminde hedef pozitifliği, böbrek-kemik iliği durumu ve önceki tedavilerin gözden geçirilmesini vurgular. [6]
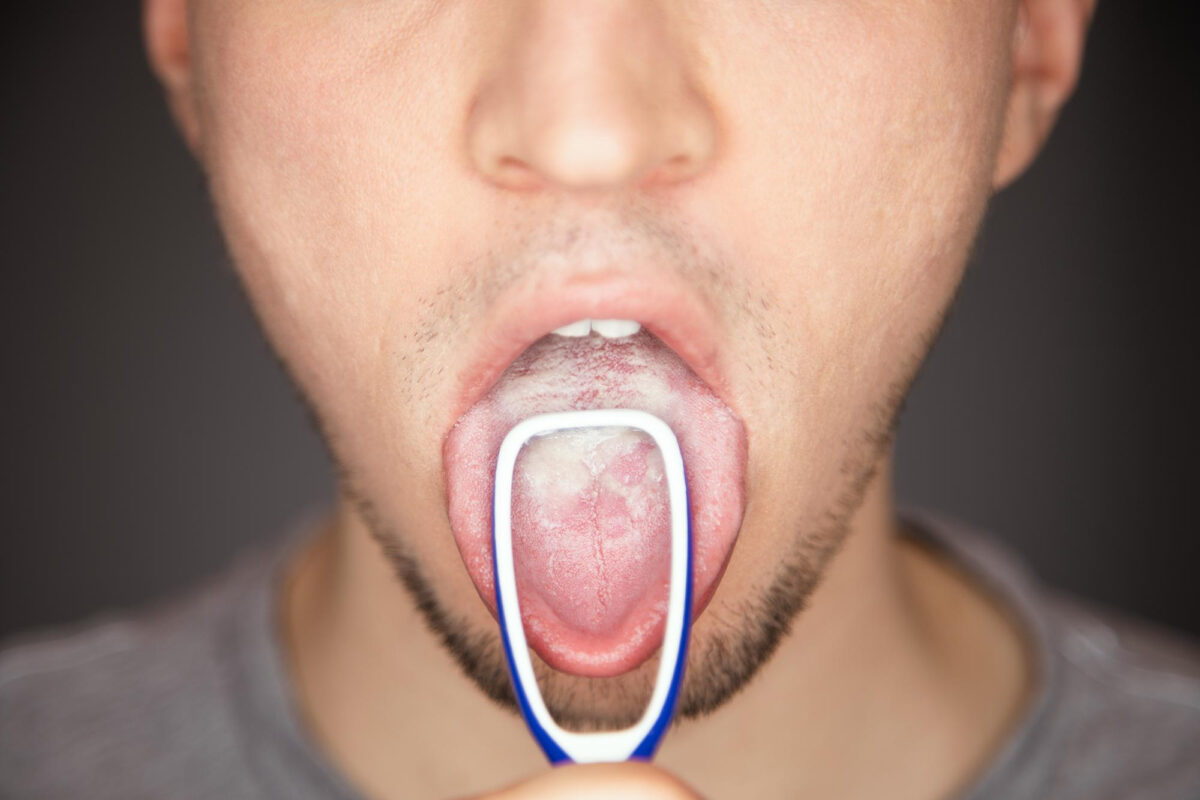
Tükürük bezleri ve ağız kuruluğu konusu
PSMA hedefli alfa tedavilerde en sık konuşulan yan etkilerden biri ağız kuruluğudur. Klinik serilerde tedaviyi bırakmaya götüren başlıca nedenlerden birinin ‘xerostomia’ (ağız kuruluğu) olduğu bildirilmiştir. [5]
Bu nedenle bazı merkezler, tükürük bezlerine yönelik koruyucu uygulamalar önerebilir. Ancak hangi yöntemin ne kadar etkili olduğu konusunda protokoller arasında farklılıklar vardır ve her uygulama herkese uygun olmayabilir. [5] [6]
İlaç etkileşimleri ve eş zamanlı tedaviler
Nöroendokrin tümörlerde somatostatin reseptörü hedefli tedavilerde, reseptöre bağlanan ilaçların zamanlaması önemlidir. Prosedür standardı, uzun etkili enjeksiyonların son dozundan sonra tedavinin en az 4 hafta sonraya planlanmasını ve kısa etkili formların da en az 24 saat önce kesilmesini önerir. [8]
Bu kural doğrudan aktinyum için yazılmamış olsa bile, hedefe bağlanmayı ‘yarıştırabilecek’ tedavilerin zamanlamasının planlamada kritik olabileceğini gösterir. Dolayısıyla kullandığınız tüm ilaçları ve takviyeleri randevu öncesinde listelemek iyi bir pratiktir. [8]
Aktinyum tedavisi nasıl uygulanır?
Uygulama ayrıntıları, hedef moleküle ve merkez protokolüne göre değişir. Yine de birçok uygulamada ortak bir iskelet bulunur: damar yolu açılır, ilaç kontrollü hızla verilir ve ardından belirli bir süre gözlem yapılır. [4] [7]
İlk insan deneyimlerinde, kilo başına 100 kBq dozun iki ayda bir uygulanması ve yanıt-toksisite izleminin en az 4 haftada bir yapılması raporlanmıştır. [4]
Daha sonra yayınlanan serilerde de 2 ay veya 8 hafta aralıkla planlanan kürler sık görülür. Nöroendokrin tümörlerde 8 haftada bir uygulanan protokoller özellikle vurgulanmıştır. [7]
Kür aralığı ve toplam kür sayısı nasıl belirlenir?
Prostat kanserine ilişkin bir seride iki ay arayla üç kür uygulanmış ve yanıt, PSA ile 4 haftada bir takip edilmiştir. [5]
Nöroendokrin tümörlerde alfa tedavisi çalışmalarında da 8 haftalık aralık sık raporlanır; fakat toplam kür sayısı, önceki PRRT kümülatif dozu ve toksisiteye göre değişebilir. [7] [10]
Bu noktada pratik bir hatırlatma: ‘Her hastaya 4 veya 6 kür’ gibi tek bir doğru yoktur. Aktinyum tedavisinde doz ve kür sayısı daha çok kişiye özel planlanan bir parametredir. [5] [7]
Hastanede yatış gerekir mi?
Radionüklid tedaviler bazı merkezlerde günübirlik uygulanabilir, bazı merkezlerde ise bir gece gözlem tercih edilir. Nöroendokrin tümörlerdeki prosedür standardı, tedavinin ayaktan verilebildiğini; ancak nadiren kusma gibi komplikasyonlarda gece yatışı gerekebileceğini belirtir. [8]
Aktinyum tedavisi için de benzer bir yaklaşım görülebilir: merkez, radyasyon güvenliği ve komplikasyon yönetimi açısından kendi kurallarına göre hareket eder. Bu nedenle ‘aynı gün taburcu’ veya ‘mutlaka yatış’ gibi genellemeler yerine, uygulama yapılacak yerin protokolü esas alınmalıdır. [8]
Tedavi sonrası takip ve günlük yaşam
Tedavi sonrası izlem iki ana başlıkta ele alınır: tıbbi takip ve radyasyon güvenliği. Tıbbi takipte kan değerleri, böbrek fonksiyonları ve gerektiğinde görüntüleme ile yanıt değerlendirilir. [5] [8]
Örneğin prostat kanseri serilerinde PSA ve kan sayımı 4 haftada bir izlenmiş; yanıtın sürekliliği ve ilerleme gibi durumlar ayrıca kaydedilmiştir. [5]
Nöroendokrin tümör prosedür standardı ise her kür öncesi ve sonrası laboratuvar takibinin önemini vurgular; çünkü olası kemik iliği baskılanması veya böbrek etkileri gecikmeli görülebilir. [8]
Evde dikkat edilmesi gereken 10 pratik nokta
Her merkez, verilen radyoaktif ilacın özelliklerine göre kişiye özel talimatlar sağlayabilir. Aşağıdaki maddeler, radionüklid tedavilerde sık geçen genel güvenlik ilkelerini özetler; sizin için geçerli olan kurallar, çıkışta yazılı olarak verilmelidir. [8] [9]
- İlk günlerde tuvalet hijyenine ekstra dikkat edin; mümkünse oturarak idrar yapın ve sifonu iki kez çekin. [8]
- İdrar ve diğer vücut sıvılarıyla temas riskini azaltmak için ayrı havlu kullanın. [8]
- Tedavi sonrası kısa süreli bol sıvı alımı, idrarla atılımı desteklemek amacıyla sık önerilen bir uygulamadır; miktarı hekiminiz netleştirir. [8] [9]
- İlk günlerde küçük çocuklar ve hamilelerle yakın temas süresi konusunda merkezinizin söylediği sınırları uygulayın. [8]
- Ağız kuruluğu varsa, gün içine yayılmış su yudumları ve şekersiz sakız gibi yaklaşımlar rahatlatıcı olabilir; bunun yanında diş hekimi kontrollerini aksatmayın. [5]
- Bulantı eğilimi olanlarda, araç kullanma ve uzun yol planını ilk 24 saatte sınırlamak daha güvenli olabilir. [8]
- Kan tahlili randevularını ertelemeyin; düşüşler erken yakalanırsa plan revize edilebilir. [8]
- Beklenmeyen ateş, kanama, nefes darlığı gibi bulgular gelişirse aynı gün sağlık ekibine ulaşın. [8]
- İlaçlarınızı (ağrı kesici, tansiyon ilacı, takviye dahil) rastgele kesmeyin; değişiklik gerekiyorsa hekim planlar. [8]
- Evde bakım veren biri varsa, kısa süreli basit önlemler (eldiven, el yıkama, çamaşır ayırma) kontaminasyon riskini azaltabilir. [8]
Yan etkiler ve olası riskler
Aktinyum tedavisinin yan etkileri, hedef molekülün hangi dokularda tutulduğuna ve kişinin organ rezervine göre değişir. Bu yüzden yan etki listesi ‘olabilir’ dilinde değerlendirilmelidir ve en doğru bilgi, uygulama yapan ekibin verdiği hasta bilgilendirme formunda yer alır. [6] [8]
Sık konuşulan yan etkiler
PSMA hedefli aktinyum tedavilerinde ağız kuruluğu öne çıkar. Bir seride tedaviyi bırakmaya neden olan başlıca durumlardan biri xerostomia olarak raporlanmıştır. [5]
Yorgunluk, bulantı veya baş dönmesi gibi genel şikâyetler radionüklid tedavilerden sonra görülebilir; çoğu zaman geçici olur, ancak şiddetli olursa değerlendirme gerekir. [8]
Kan değerlerinde düşme (anemi, lökopeni, trombositopeni) riski, özellikle daha önce yoğun tedavi almış hastalarda daha yakından izlenir. Bu nedenle hem tedavi öncesi eşik değerler hem de tedavi sırasında düzenli kan sayımı kritik kabul edilir. [8]
Böbrek ve karaciğer etkileri
Nöroendokrin tümörlerde PRRT prosedür standardı, böbrek fonksiyonlarının her kür öncesinde kontrol edilmesini önerir ve idrarla atılım nedeniyle böbreklerin izlemde önemli bir organ olduğunu vurgular. [8]
Aktinyum-225 ile yapılan küçük bir prospektif çalışmada ciddi böbrek veya karaciğer toksisitesi gözlenmediği bildirilmiştir; ancak hasta sayısı sınırlı olduğundan bu sonuç ‘herkeste risk yok’ anlamına gelmez. [10]
Böbrek hastalığı, diyabet veya hipertansiyon gibi durumlar varsa, risk değerlendirmesi daha ayrıntılı yapılır ve takip aralıkları sıklaştırılabilir. [8]
Uzun vadeli riskler neden önemlidir?
Radionüklid tedavilerde geç dönem etkiler, tedaviden aylar sonra ortaya çıkabilir. Örneğin alfa-PRRT alanında yapılan bir derlemede, beta yayıcı PRRT sonrasında nadir de olsa kalıcı sitopeni veya miyelodisplazi gibi sorunların bildirildiği vurgulanır. [3]
Aktinyum tedavileri için uzun dönem veri setleri daha sınırlıdır. Bu yüzden hekimler, kısa dönem yanıtla birlikte uzun dönem güvenliği de yakından izlemeye çalışır ve ‘düzenli kontrol’ vurgusu bu noktada önem kazanır. [1] [3]
Yan etkileri azaltmaya yönelik pratik stratejiler
Yan etki yönetimi, tedavinin kendisi kadar önemlidir. Burada amaç, toleransı artırmak ve gereksiz kesintilerin önüne geçmektir. Stratejiler hastaya göre değişse de bazı ortak noktalar vardır. [8]
Nöroendokrin tümörlerde kılavuzlar, böbrekleri korumaya yönelik aminoasit infüzyonları ve bulantı önleyici ilaçların planın bir parçası olabildiğini belirtir. Bu, hedefli radionüklid tedavilerde destek tedavisinin standart bir bileşen olabileceğini gösterir. [8]
Ağız kuruluğu riskinin yüksek olduğu durumlarda ağız hijyeni, diş hekimi izlemi ve semptom giderici yaklaşımlar günlük yaşam kalitesini belirgin etkileyebilir. Xerostomia, bazı serilerde tedaviyi bırakma nedeni olabildiği için erken dönemde yönetilmesi önemlidir. [5]
Tedavinin etkinliğine dair bilimsel veriler nasıl okunmalı?
Aktinyum tedavisiyle ilgili yayınlar çoğu zaman ‘seçilmiş’ ve ileri evre hasta gruplarını içerir. Bu nedenle sonuçlar heyecan verici görünse de, her hasta için aynı düzeyde geçerli olacağını varsaymak doğru değildir. [5] [7]
Prostat kanserinde 40 hastalık bir seride, 8 hafta yaşayabilen hastaların %63’ünde PSA’da %50’den fazla düşüş; %87’sinde ise herhangi bir derecede PSA yanıtı raporlanmıştır. Aynı yayında median tümör kontrol süresi 9 ay olarak verilmiştir. [5]
Nöroendokrin tümörlerde 32 hastayı içeren prospektif çalışmada, değerlendirilebilen 24 hastanın 15’inde parsiyel yanıt ve 9’unda stabil hastalık bildirilmiştir. Çalışmanın takip süresi kısa olduğundan uzun dönem sonuçlar için daha fazla veriye ihtiyaç olduğu da aynı metinde vurgulanır. [7]
10 hastalık bir prospektif seride, hastalık kontrol oranı %80 olarak bildirilmiş ve median 14 aylık takipte ölüm raporlanmamıştır. Bununla birlikte bu tür küçük seriler, kesin karşılaştırma yapmaya yetmez; daha büyük ve kontrollü çalışmalara ihtiyaç vardır. [10]
Özetle, etkinlik verilerini okurken üç soruyu akılda tutmak faydalıdır: Hasta grubu ne kadar seçilmiş, takip süresi ne kadar uzun ve yanıt nasıl ölçülmüş? Bu sorular, beklentiyi gerçekçi tutmaya yardımcı olur. [3] [6]
Tedavi planlamasında pratik başlıklar
Aktinyum tedavisi çoğu zaman yüksek teknoloji, özel hazırlık ve sınırlı tedarik zinciri gerektiren bir alandır. Bu nedenle süreç sadece tıbbi değil, lojistik açıdan da planlama ister. [1]
Kürler arası 6–8 haftalık aralıklar klinik çalışmalarda sık görülse de, randevuların planlanması, kan tahlillerinin zamanlanması ve görüntülemelerin ayarlanması kişiye özel yapılır. [5] [7]
Maliyet, geri ödeme ve erişim konusu ülkeden ülkeye değişir. En sağlıklı yaklaşım, tedaviye başlamadan önce yazılı plan istemek ve ‘kür sayısı, takip testleri ve olası ek işlemler’ gibi kalemleri netleştirmektir. [6] [8]
Aktinyum tedavisi öncesi hedef görüntüleme ve dozimetri
Hedefli radionüklid tedavilerde en kritik adım, tümörün hedefi gerçekten taşıdığını göstermektir. Prostat kanserinde PSMA hedefi için, nöroendokrin tümörlerde ise somatostatin reseptörleri için yapılan nükleer tıp görüntülemeleri bu nedenle ‘kapıdan giriş’ testleri gibi düşünülür. [6] [8]
Nöroendokrin tümörlerdeki prosedür standardı, lezyon tutulumunun arka plan karaciğer tutulumundan daha yüksek olmasını pratik bir eşik olarak tanımlar. Bu yaklaşım, ilacın tümör yerine normal dokuda birikme olasılığını azaltmayı amaçlar. [8]
Prostat kanserinde de benzer mantık vardır: hedef pozitifliği sadece ‘var-yok’ değildir; tutulum yoğunluğu ve lezyonlar arası heterojenlik tedavinin başarısını etkileyebilir. Bazı odaklar hedef negatifse, o odaklar tedaviye dirençli kalabilir ve planın yeniden düzenlenmesi gerekebilir. [6]
Bazı merkezlerde ‘dozimetri’ adı verilen ek hesaplamalar yapılabilir. Dozimetri, verilen radyoaktif ilacın böbrek, tükürük bezi ve kemik iliği gibi kritik organlarda bırakabileceği emilen dozu kabaca öngörmeyi hedefler. Bu sayede doz veya kür sayısı daha kişiselleştirilmiş biçimde ayarlanabilir. [6] [8]
Dozimetri her hasta için zorunlu değildir; çünkü uygulama kaynakları ve protokoller değişir. Yine de özellikle sınırda böbrek fonksiyonu olan veya yoğun tedavi geçmişi bulunan hastalarda, güvenlik marjını artırmak için değerlendirilebilir. [6] [8]
Kimlerde dikkatli olunmalı veya ertelenebilir?
Aktinyum tedavisinde ‘kesin yasak’ listesi, hedef molekül ve merkez protokolüne göre değişebilir. Buna karşın radyofarmasötik tedavilerde güvenlik açısından ortak kabul gören bazı durumlar vardır ve bu durumlarda plan genellikle ertelenir veya alternatifler düşünülür. [8] [9]
Özellikle gebelik ve emzirme konusu, radyasyon güvenliği nedeniyle ayrı bir hassasiyete sahiptir. Lu-177 PRRT prosedür standardı, gebelikte radyofarmasötik tedavinin neredeyse evrensel biçimde kontrendike olduğunu; emzirmenin de tedavi için durdurulması gerektiğini vurgular. [8]
Aynı standart, emzirmenin son tedaviden sonra 2,5 ay geçmeden yeniden başlatılmamasını ve doğurganlık çağındaki bireylerde son kürden sonra 6 ay süreyle etkin korunma kullanılmasını önerir. Bu süreler aktinyum protokollerinde değişebileceğinden, kesin zamanlama için uygulama merkezinin yazılı talimatı esas alınmalıdır. [8]
Diğer risk başlıkları ise daha çok ‘organ rezervi’ ile ilgilidir. Böbrek fonksiyonları sınırlı olan, aktif enfeksiyonu bulunan, yakın dönemde yoğun kemoterapi almış veya kemik iliği rezervi düşük olan hastalarda yan etki riski artabilir. Bu durumlarda dozun azaltılması, kür aralığının uzatılması veya tedavinin ertelenmesi gündeme gelebilir. [6] [8]
Pratikte sık değerlendirilen dikkat noktaları şunlardır:
- Gebelik: Radyofarmasötik tedavilerde genellikle kontrendike kabul edilir. [8]
- Emzirme: Tedavi süresince bırakılması ve yeniden başlama zamanının merkeze göre planlanması gerekir. [8]
- Ağır böbrek yetmezliği: Böbrek izlem ve doz ayarlaması açısından yüksek riskli gruptur. [8]
- Belirgin kemik iliği baskılanması: Başlangıç kan değerleri düşükse toksisite riski artar. [8]
- Kontrolsüz enfeksiyon veya ciddi genel durum bozukluğu: Önce stabilizasyon hedeflenir. [6]
Takipte hangi görüntüleme yöntemleri kullanılır?
Yanıt değerlendirmesinde tek bir ölçüt yoktur. Bazı hastalarda biyobelirteçler (örneğin prostat kanserinde PSA) hızlı ipucu verirken, bazı hastalarda görüntüleme daha belirleyicidir. Bu nedenle takip planı çoğu zaman kombine yürütülür. [5] [6]
Prostat kanserinde aktinyum-225 ile yapılan bir seride başlangıç evreleme ve 6. ayda kontrol için hedef görüntülemelerinin kullanıldığı belirtilmiştir. Bu, ‘erken dönemde kan değerleriyle izlem + belirli aralıklarla görüntüleme’ yaklaşımının tipik bir örneğidir. [5]
Nöroendokrin tümörlerde ise çalışmalar, yanıtı hem klasik boyut ölçütleriyle (RECIST gibi) hem de fonksiyonel kriterlerle birlikte değerlendirmiştir. Bu çift yönlü değerlendirme, tümörün küçülmesinden önce reseptör tutulumunda azalma gibi erken işaretleri yakalayabilmeyi amaçlar. [7]
Görüntüleme aralıkları kişiye özel seçilir. Çok hızlı ilerleyen tabloda daha sık görüntüleme gerekebilirken, stabil giden hastada gereksiz görüntüleme yerine laboratuvar ve klinik takip ön plana çıkarılabilir. [6] [8]
Aktinyum tedavisi ve yaşam kalitesi: Beklentiyi doğru kurmak
Bir tedavinin değeri sadece tümör kontrolüyle değil, günlük yaşam üzerindeki etkisiyle de ölçülür. Bu nedenle bazı çalışmalar, yaşam kalitesi ölçeklerini ve semptom skorlarını takip protokolüne ekler. [7] [10]
Örneğin nöroendokrin tümörlerde aktinyum-225 alfa tedavisi çalışmasında, yaşam kalitesi değerlendirmesi için hasta bildirimli anketlerin kullanıldığı ve bazı semptomlarda iyileşme gözlendiği raporlanmıştır. Bu tür bulgular, özellikle hormon salgılayan tümörlerde semptom yönetiminin önemini vurgular. [7]
Bununla birlikte yaşam kalitesi, yan etkilerle doğrudan ilişkilidir. Ağız kuruluğu gibi ‘hayatı tehdit etmeyen’ ama gündelik konforu belirgin bozan etkiler, tedaviye devam kararını etkileyebilir. Bu yüzden semptomları küçümsemeden erken paylaşmak, planın sürdürülebilirliği açısından kritiktir. [5]
Sıkça sorulan sorular
Aktinyum tedavisi kemoterapinin yerine mi geçer?
Genellikle ‘yerine’ değil, belirli bir basamakta ‘alternatif veya tamamlayıcı seçenek’ olarak değerlendirilir. Hangi basamakta düşünüleceği, tümör tipine ve önceki tedavilere bağlıdır. [6]
Tedavi öncesi özel diyet veya açlık gerekir mi?
Birçok protokolde özel bir açlık şartı olmayabilir; ancak eşlik eden ilaçlar ve uygulanacak destek infüzyonları nedeniyle merkeziniz size net bir hazırlık listesi verir. En doğrusu, randevu öncesi yazılı talimatı takip etmektir. [8]
Her hastada hedef görüntülemesi şart mı?
Hedefli radionüklid tedavilerde, hedefin görüntüleme ile doğrulanması temel yaklaşımdır. Çünkü ilaç hedefe bağlanarak etki gösterir; hedef yoksa beklenen yarar düşebilir ve risk artabilir. [6] [8]
Kürler ne kadar sürer?
Uygulama süresi protokole göre değişir. Bazı uygulamalarda radyoaktif ilaç damardan kontrollü hızla verilir; ek destek infüzyonları varsa ziyaret süresi uzayabilir. PRRT prosedür standardı, bir tedavi ziyaretinin yaklaşık 5–8 saat sürebildiğini belirtir. [8]
Yan etkiler hemen mi ortaya çıkar?
Bazı şikâyetler (bulantı, yorgunluk gibi) ilk günlerde görülebilir. Kan değerlerindeki düşüş veya böbrek etkileri ise günler-haftalar içinde ortaya çıkabileceği için düzenli laboratuvar takibi önemlidir. [8]
Ağız kuruluğu kalıcı olur mu?
Ağız kuruluğu, PSMA hedefli aktinyum tedavilerinde öne çıkan bir yan etkidir ve bazı hastalarda belirgin olabilir. Bazı serilerde tedaviyi bırakma nedeni olarak raporlandığı için erken dönemde hekiminize bildirmek önemlidir. Kalıcılık kişiden kişiye değişebilir. [5]
Tedavi sonrası evde izolasyon gerekir mi?
Çoğu merkez, ‘tam izolasyon’ yerine kısa süreli basit önlemler önerir. Bu önlemler, vücut sıvılarıyla kontaminasyonu azaltmaya ve yakın temas süresini düzenlemeye yöneliktir. Hangi süre ve kuralların geçerli olduğu, uygulanan izotope ve yerel mevzuata göre değişir. [8] [9]
Takipte hangi tetkikler yapılır?
Takip; tam kan sayımı, böbrek-karaciğer fonksiyon testleri ve klinik şikâyetlerin değerlendirilmesini içerir. Prostat kanserinde PSA gibi biyobelirteçler sık kullanılır ve bazı serilerde 4 haftada bir takip raporlanmıştır. Ayrıca uygun aralıklarla görüntüleme ile yanıt değerlendirilir. [5] [8]
Aktinyum tedavisi hakkında akılda kalması gerekenler
Aktinyum tedavisi hedefe yönelik, alfa parçacığı yayan, giderek daha fazla klinik araştırmanın odağında olan bir yöntemdir. Etki alanı kısa ve enerjisi yüksek olduğundan, doğru hasta ve doğru hedef seçimi kritik önemdedir. [3] [6]
Mevcut kanıtlar özellikle ileri evre prostat kanserinde ve seçilmiş nöroendokrin tümörlerde umut verici sonuçlar bildirse de, protokoller arasında farklılıklar vardır ve uzun dönem veriler birçok alanda hâlâ birikmektedir. [5] [7]
Bu nedenle tedavi düşünülüyorsa, hedef görüntüleme sonuçları, organ fonksiyonları ve önceki tedavilerle birlikte kişiye özel bir risk-yarar değerlendirmesi yapılması en güvenli yaklaşımdır. [6] [8]
Kaynaklar
- [1] Jang A, van der Doelen MJ, de Vries R, et al. Targeted Alpha-Particle Therapy: A Review of Current Trials. Int J Mol Sci. 2023. https://doi.org/10.3390/ijms241411626
- [2] National Cancer Institute. Radiation Therapy for Cancer (Targeted Radionuclide Therapy bölümü). 2025. https://www.cancer.gov/about-cancer/treatment/types/radiation-therapy
- [3] Leupe H, et al. Clinical Experience with Targeted Alpha-Emitter Peptide Receptor Radionuclide Therapy (α-PRRT) for Somatostatin Receptor-Positive Neuroendocrine Tumors. 2025. https://pmc.ncbi.nlm.nih.gov/articles/PMC12655202/
- [4] Kratochwil C, et al. 225Ac-PSMA-617 for PSMA-Targeted α-Radiation Therapy of Metastatic Castration-Resistant Prostate Cancer. J Nucl Med. 2016. https://pubmed.ncbi.nlm.nih.gov/27390158/
- [5] Kratochwil C, et al. Targeted α-Therapy of Metastatic Castration-Resistant Prostate Cancer with 225Ac-PSMA-617: Swimmer-Plot Analysis. J Nucl Med. 2018. https://pubmed.ncbi.nlm.nih.gov/29326358/
- [6] Kratochwil C, Fendler WP, Eiber M, et al. Joint EANM/SNMMI procedure guideline for the use of 177Lu-labeled PSMA-targeted radioligand-therapy. Eur J Nucl Med Mol Imaging. 2023. https://doi.org/10.1007/s00259-023-06255-8
- [7] Ballal S, et al. Broadening horizons with 225Ac-DOTATATE targeted alpha therapy for gastroenteropancreatic neuroendocrine tumour patients stable or refractory to 177Lu-DOTATATE PRRT. Eur J Nucl Med Mol Imaging. 2020. https://pubmed.ncbi.nlm.nih.gov/31707430/
- [8] Hope TA, Bodei L, Chan JA, et al. NANETS/SNMMI Procedure Standard for Somatostatin Receptor–Based Peptide Receptor Radionuclide Therapy with 177Lu-DOTATATE. 2019. https://nanets.net/images/guidelines/NANETS_Guidelines_2019_Procedure_Standard_for_Radionuclide_Therapy_with_177Lu-DOTATATE_1.pdf
- [9] Hosono M, et al. Manual on the proper use of lutetium-177-labeled somatostatin analogue injectable in radionuclide therapy (2nd ed.). 2018. https://pmc.ncbi.nlm.nih.gov/articles/PMC5852188/
- [10] Yang H, et al. Efficacy and Safety of 225Ac-DOTATATE in the Treatment of Neuroendocrine Neoplasms With High SSTR Expression. 2024. https://pubmed.ncbi.nlm.nih.gov/38498615/
...
Yasal Uyarı ve Sorumluluk Reddi: Bu blogda yer alan tüm içerikler yalnızca genel bilgilendirme amaçlıdır ve yayınlandığı tarihteki mevcut bilimsel verilere dayanarak hazırlanmıştır. Söz konusu bilgiler, profesyonel tıbbi tavsiye, teşhis veya tedavi yerine geçmez. Sağlığınızla ilgili herhangi bir soru, endişe veya ihtiyaç durumunda, lütfen bir doktora ya da yetkin bir sağlık kuruluşuna başvurunuz. Bu blogda sunulan bilgilerin kullanımı tamamen okuyucunun sorumluluğundadır. Blog sahibi, yazarlar veya bağlı kuruluşlar, bu içeriklerin doğruluğu, güncelliği veya eksiksizliği konusunda herhangi bir garanti vermez ve bu bilgilerin kullanımından kaynaklanabilecek doğrudan veya dolaylı herhangi bir zarar veya kayıptan sorumlu tutulamaz. Sağlık durumunuza ilişkin kararlar almadan önce, mutlaka bir sağlık uzmanına danışmanız gerektiğini unutmayınız. Bu blog, tıbbi bir hizmet sunmamakta olup yalnızca bilgilendirme amacı taşımaktadır.

























 Housing Filtre Setleri
Housing Filtre Setleri Arıtma Cihazı Filtre Setleri
Arıtma Cihazı Filtre Setleri Duş Filtreleri
Duş Filtreleri Housing Filtreler
Housing Filtreler Membran Filtreler
Membran Filtreler UV Filtreler
UV Filtreler Yıkanabilir Filtreler
Yıkanabilir Filtreler Analiz Cihazları
Analiz Cihazları Basınç Ayarlayıcılar
Basınç Ayarlayıcılar Çekvalfler
Çekvalfler Clipsler
Clipsler Fittingsler
Fittingsler Hortum
Hortum Housing Anahtarları
Housing Anahtarları Housingler
Housingler Musluk
Musluk Pompa
Pompa Su Analiz Kitleri ve Cihazları
Su Analiz Kitleri ve Cihazları Switchler & Solenoid Valfler
Switchler & Solenoid Valfler Tank
Tank Valfler
Valfler
 Aktif Karbon Filtreleri
Aktif Karbon Filtreleri Arsenik Arıtma Sistemleri
Arsenik Arıtma Sistemleri Biyolojik Arıtım Sistemleri
Biyolojik Arıtım Sistemleri Elektrodeiyonizasyon Sistemleri
Elektrodeiyonizasyon Sistemleri Endüstriyel Ekipmanlar
Endüstriyel Ekipmanlar Gri Su Arıtma Sistemleri
Gri Su Arıtma Sistemleri MBR Arıtım Sistemleri
MBR Arıtım Sistemleri Ultrafiltrasyon Sistemleri
Ultrafiltrasyon Sistemleri Yumuşatma Sistemleri
Yumuşatma Sistemleri