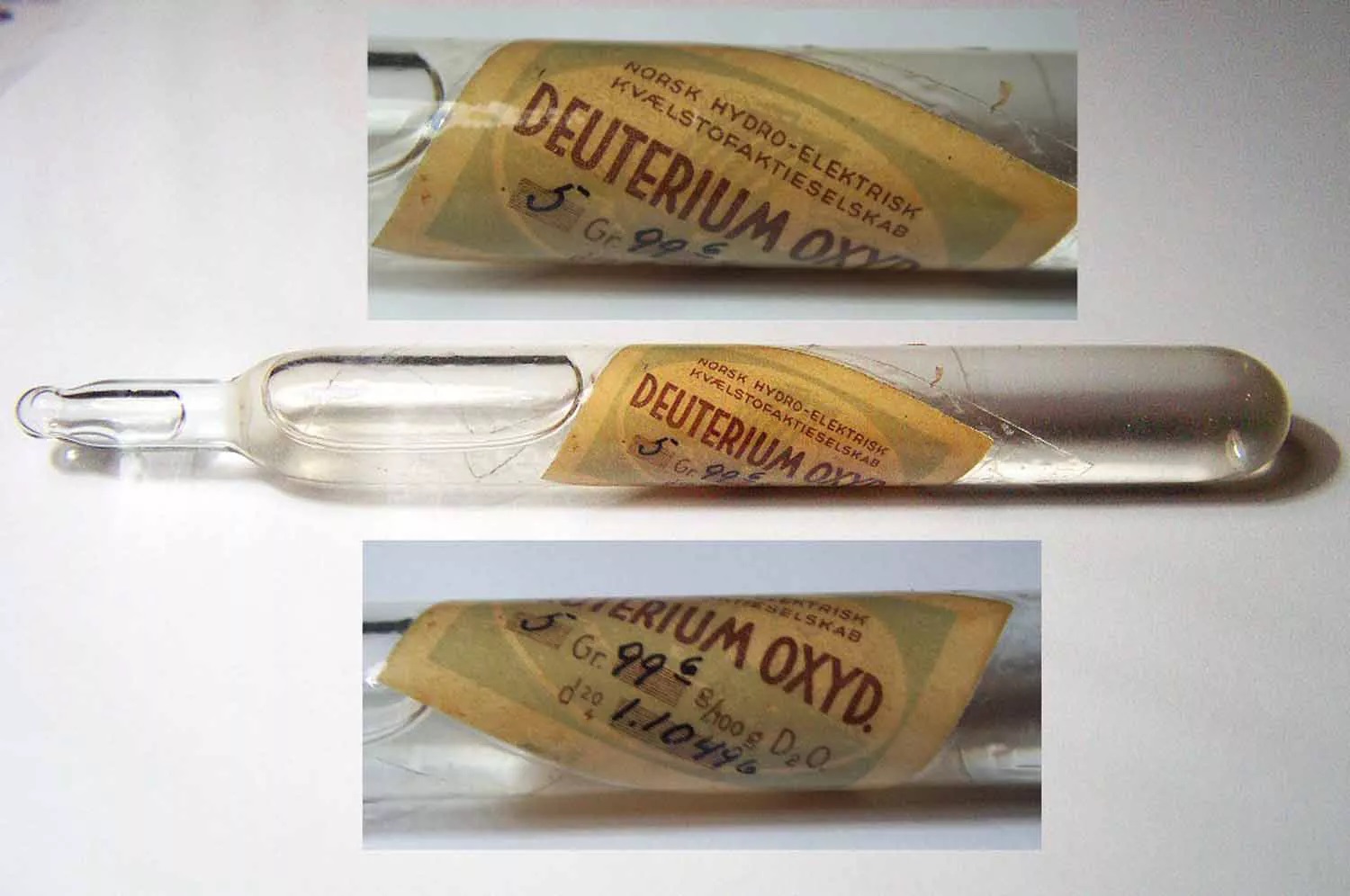
Blog
Ağır su (D2O), doğal oranlardan (6.500’de bir) çok daha fazla ağır hidrojen (döteryum, D) atomu içeren sudur. Ağır su, bazı nükleer reaktörlerde moderatör olarak kullanılır çünkü nötronları etkili bir şekilde yavaşlatır ve ayrıca düşük bir nötron emilimi olasılığına sahiptir.
Döteryumun atom kütlesi, hidrojenin yaygın izotopu olan protiyumunkinden daha büyük olduğu için, ağır suyun molar kütlesi normal sudan daha yüksektir. Bu durum, ağır suyun (D2O), H2O ile karşılaştırıldığında biraz farklı kimyasal ve fiziksel özelliklere sahip olmasına neden olur.
Bu yazıda, ağır suyun özelliklerini, nasıl elde edildiğini, farklı türlerini, önemli reaksiyonlarını ve kullanım alanlarını inceleyeceğiz.
Normal su gibi, ağır su veya döteryum oksit renksizdir ve H2O ile aynı reaksiyonların çoğuna katılır. Bununla birlikte, çoğu insan iki tür suyun tadının farklı olduğunu bildirir. Ağır suyun hafif tatlı bir tadı vardır. Ağır sudan yapılan buz küpleri ağır suda yüzer, ancak normal suda batar.
Ağır Suyun Özellikleri
| Ağır Su (Döteryum Oksit) | D2O |
| Moleküler Kütle | 20.02 gram/mol |
| Yoğunluk | 1.107 g/mL |
| Dipol Momenti | 1.87 D |
| Erime Noktası | 3.82 °C |
| Kaynama Noktası | 101.4 °C |
Fiziksel Özellikler
- Ağır su, standart sıcaklık ve basınçta (STP) renksiz görünür.
- Oda sıcaklığında kokusuz bir sıvı halinde bulunur.
- D2O’nun yoğunluğu H2O’dan yaklaşık %11 daha fazla olduğu için, ağır sudan yapılmış bir buz küpü normal suda batar.
- Ağır su, normal su ile karıştırıldığında homojen bir karışım oluşturur.
Kimyasal Özellikler
- Hidrojen izotopları, atom kütlelerindeki farklılıklar nedeniyle farklı kimyasal davranışlar sergiler.
- Yüksek miktarda döteryumun varlığından kaynaklanan çözücü özelliklerindeki değişiklikler, biyolojik sistemleri olumsuz etkileyebilir.
- Normal su, ağır suya kıyasla daha fazla ayrışır.
- Belirli bir sıcaklıkta, bir D+2O örneğindeki D+ iyonlarının konsantrasyonu genellikle bir H+2O örneğindeki H+ iyonlarının konsantrasyonundan daha düşüktür.
Ağır Su Hazırlama Yöntemleri
Ağır su, alkali içeren suyun uzun süreli elektrolizi yoluyla elde edilir.
- Elektrolit: NaOH içeren su
- Katot: Çelik kap
- Anot: Delikli nikel levha
Elektroliz, CO2 gazının geçişiyle nötralize edilen yedi alkali için devam ettirilir. Geriye kalan ürün ağır sudur. Ağır suyun bazı önemli özellikleri aşağıda listelenmiştir:
- Bir döteryum atomunun çekirdeği, bir proton ve bir nötron içerir, bu da onu protiyumdan (normal suda bulunan hidrojen izotopu, 1H ile gösterilir) kabaca iki kat daha ağır yapar.
- Bir su molekülünün moleküler kütlesinin yaklaşık %89’u oksijene atfedilir. Bu nedenle, D2O’nun moleküler kütlesi, H2O’nunkinden önemli ölçüde daha büyük değildir.
- Ağır suyun yoğunluğu, normal sudan yaklaşık %11 daha yüksektir.
- D2O’daki döteryum-oksijen bağı, H2O’daki protiyum-oksijen bağından daha güçlüdür.
- D2O, döteryum atomunun radyoaktif bozunmaya uğramaması nedeniyle doğada radyoaktif değildir.
- Yüksek dozlarda ağır su, birçok organizma için toksik olabilir.
Ağır suyun ilk üretimi 1932 yılında gerçekleşti. Basınçlı ağır su reaktörlerinde (PHWR) nötron moderatörü ve soğutucu olarak kullanılır. “Ağır su” terimi tipik olarak D2O’yu ifade eder. Ancak, suyun başka “ağır” formları da mevcuttur.
Ağır Su Türleri
Yarı Ağır Su (HDO)
- Bu tür ağır su, HDO formülü ile gösterilir ve bir protiyum, bir döteryum ve bir oksijen atomundan oluşur.
- Su molekülleri, hidrojen atomlarını birbirleriyle değiştirme eğilimindedir. Bu, HDO’nun hem protiyum hem de döteryum içeren su örneklerinde bulunabileceği anlamına gelir.
- Eşit oranda protiyum ve döteryum içeren bir su örneği, %50 yarı ağır su, %25 normal su ve %25 ağır sudan oluşur.
- Bu örnekte, HDO, D2O ve H2O arasında dinamik bir denge vardır.
Ağır Oksijenli Su
- 17O ve 18O gibi daha ağır oksijen izotopları içeren suya ağır oksijenli su denir.
- Yoğunluğu normal sudan daha yüksektir, bu nedenle bir tür ağır su olarak sınıflandırılır.
- 18O oksijen izotopu içeren ağır oksijenli su, 18F flor izotopunun üretiminde kullanılır. Ayrıca radyoizleyiciler ve radyofarmasötiklerde de kullanılır.
Trityumlu Su (T2O)
- Protiyum yerine trityum (T veya 3H ile gösterilir) içeren radyoaktif bir su formudur.
- Genellikle süper ağır su olarak adlandırılır ve T2 formülü ile gösterilir.
- Trityumlu su, bir vücuttaki toplam su hacmini belirlemek için kullanılabilir.
- T2O’nun molar kütlesi 22.03 gram/mol ve yoğunluğu 1.85 g/mL’dir.
Ağır Suyun Önemli Reaksiyonları
- Elektroliz: 2D2O → 2D2 (Döteryum) + O2
- Metallerle Reaksiyonları: 2Na + 2D2O → 2NaOD (Sodyum Döteroksit) + D2
- Ametallerle Reaksiyonları: D2O + Cl2 → DCl + DOCl
- Metal Oksitlerle Reaksiyonları: MgO + D2O → Mg(OD)2
- Ametal Oksitlerle Reaksiyonları: SO3 + D2O → D2SO4 (Dötero Sülfürik Asit)
- Magnezyum Nitrürle Reaksiyonları: Mg3N2 + 6D2O → 3Mg(OD)2 + 2ND3 (Dötero Amonyak)
- Kalsiyum Fosfürle Reaksiyonları: Ca3P2 + 6D2O → 3Ca(OD)2 + 2PD3 (Dötero Fosfür)
- Kalsiyum Karbürle Reaksiyonları: CaC2 + 2D2O → Ca(OD)2 + C2D2 (Dötero Asetilen)
- Alüminyum Karbürle Reaksiyonları: Al4C3 + 12D2O → 4Al(OD)3 + 3CD4 (Dötero Metan)
Diğer Kullanım Alanları
- Ağır su, nükleer manyetik rezonans spektroskopisinde kullanılır.
- Bazı nükleer reaktör tiplerinde moderatör olarak kullanılır.
- İnsanlarda metabolik hızı test etmek için tıp alanında kullanılır.
Ağır Suyun Kullanım Alanları
Daha önce bahsedildiği gibi, ağır su, nükleer reaktörlerde soğutucu ve nötron moderatörü olarak kullanılan önemli bir bileşendir. Ağır suyun diğer bazı önemli kullanım alanları aşağıda listelenmiştir:
- Döteryum Elde Etmek: Ağır su, döteryumun hazırlanmasında kullanılır.
- Solunum ve Fotosentez Mekanizmalarını İncelemek: Ağır su, solunum ve fotosentez mekanizmalarını incelemek için izleyici olarak kullanılır.
- Nükleer Manyetik Rezonans (NMR) Spektroskopisi: D2O, atom çekirdekleri etrafındaki manyetik alanları gözlemlemek için kullanılan NMR spektroskopisinde kullanılır.
- Organik Bileşiklerin İzotoploglarının Hazırlanması: Birçok organik bileşiğin izotoplogları, ağır su yardımıyla hazırlanır.
- Kızılötesi (IR) Spektroskopisi: Ağır su, genellikle IR spektroskopisinde normal su yerine kullanılır.
- Nükleer Reaktörlerde Moderatör: Ağır su, nükleer reaktörlerde nötronları yavaşlatmak için moderatör olarak kullanılır. Hızlı hareket eden nötronları yavaşlatabildiği için, 238U izotopu yerine 235U izotopu ile reaksiyona girebilirler.
- Metabolik Hız Testi: İnsan ve hayvanlardaki metabolik hız, D2O ve ağır oksijenli su karışımı kullanılarak test edilir.
- Kontrollü Nükleer Füzyon Reaksiyonları: Ağır suda bulunan döteryum bir nötron yakaladığında, kontrollü nükleer füzyon reaksiyonlarında kullanılan aktif madde olan trityum oluşur.
Bu yazıda, ağır suyun ne olduğunu, özelliklerini, nasıl elde edildiğini, farklı türlerini ve kullanım alanlarını inceledik. Ağır su, nükleer enerji, kimya ve tıp gibi birçok alanda önemli bir role sahiptir.
Ağır Su İçilir Mi? Tehlikeli Midir?
Çoğu zaman, ağır sudan bahsettiğimizde, onu nükleer reaktörler ve radyoaktif maddelerle ilişkilendirme eğilimindeyiz. Ancak, saf ağır su radyoaktif değildir ve insanlar tarafından az miktarda tüketildiğinde zararlı değildir. Sadece büyük miktarlarda veya uzun süre tüketildiğinde zararlı veya tehlikeli hale gelir. Zehirlenme meydana gelebilir ve baş dönmesi ve kan basıncı düşmesi gibi semptomlara yol açabilir.
Sıkça Sorulan Sorular (SSS)
S1: Ağır suyun kimyasal formülü nedir?
D2O ağır suyun formülüdür.
S2: Ağır suyun kaynama noktası nedir?
101.4°C ağır suyun kaynama noktasıdır. Suyun kaynama noktasından biraz daha yüksektir.
S3: Ağır su nasıl hazırlanır?
Ağır su, alkali suyun elektrolizi ile hazırlanır.
S4: Ağır su hazırlanmasında kullanılan elektrolit, anot ve katot nedir?
- Elektrolit: Alkali su
- Anot: Delikli nikel levha
- Katot: Çelik kap
S5: Suyun radyoaktif formu nedir?
T2O suyun radyoaktif formudur.
Kaynaklar
- Heavy Water (D2O) | NRC.gov
- Heavy water – Wikipedia
- Harold C. Urey | Nobel Prize-Winning Chemist | Britannica
- Döteryum oksit – Amerikan Kimya Derneği (acs.org)
Hakkında Ethic Water
Ethic Water, su arıtma teknolojileri alanında yıllara dayanan tecrübesiyle hizmet veren güvenilir ve uzman bir firmadır. Temiz ve sağlıklı suya erişimi herkes için mümkün kılma misyonuyla yola çıkan Ethic Water; su arıtma cihazları, içme suyu kalitesi ve suyun insan sağlığı üzerindeki etkileri hakkında güncel ve bilimsel içerikler üretmektedir. Yayınladığı blog yazılarında, hakemli akademik dergilerde yayımlanmış bilimsel çalışmalardan alıntılar ve güncel literatür taramaları kullanarak bilgi sunmaya özen gösterir. Profesyonel teknik kadrosu ve etik hizmet anlayışıyla müşterilerine sürdürülebilir çözümler sunan Ethic Water, suyun yaşam için taşıdığı önemi anlatan bilgilendirici blog yazılarıyla da fark yaratmayı hedeflemektedir.
Ethic Water tarafından yazılan tüm gönderileri görüntüleYasal Uyarı ve Sorumluluk Reddi: Bu blogda yer alan tüm içerikler yalnızca genel bilgilendirme amaçlıdır ve yayınlandığı tarihteki mevcut bilimsel verilere dayanarak hazırlanmıştır. Söz konusu bilgiler, profesyonel tıbbi tavsiye, teşhis veya tedavi yerine geçmez. Sağlığınızla ilgili herhangi bir soru, endişe veya ihtiyaç durumunda, lütfen bir doktora ya da yetkin bir sağlık kuruluşuna başvurunuz. Bu blogda sunulan bilgilerin kullanımı tamamen okuyucunun sorumluluğundadır. Blog sahibi, yazarlar veya bağlı kuruluşlar, bu içeriklerin doğruluğu, güncelliği veya eksiksizliği konusunda herhangi bir garanti vermez ve bu bilgilerin kullanımından kaynaklanabilecek doğrudan veya dolaylı herhangi bir zarar veya kayıptan sorumlu tutulamaz. Sağlık durumunuza ilişkin kararlar almadan önce, mutlaka bir sağlık uzmanına danışmanız gerektiğini unutmayınız. Bu blog, tıbbi bir hizmet sunmamakta olup yalnızca bilgilendirme amacı taşımaktadır.


 Housing Filtre Setleri
Housing Filtre Setleri Arıtma Cihazı Filtre Setleri
Arıtma Cihazı Filtre Setleri Duş Filtreleri
Duş Filtreleri Housing Filtreler
Housing Filtreler Membran Filtreler
Membran Filtreler UV Filtreler
UV Filtreler Yıkanabilir Filtreler
Yıkanabilir Filtreler Analiz Cihazları
Analiz Cihazları Basınç Ayarlayıcılar
Basınç Ayarlayıcılar Çekvalfler
Çekvalfler Clipsler
Clipsler Fittingsler
Fittingsler Hortum
Hortum Housing Anahtarları
Housing Anahtarları Housingler
Housingler Musluk
Musluk Pompa
Pompa Su Analiz Kitleri ve Cihazları
Su Analiz Kitleri ve Cihazları Switchler & Solenoid Valfler
Switchler & Solenoid Valfler Tank
Tank Valfler
Valfler Aktif Karbon Filtreleri
Aktif Karbon Filtreleri Arsenik Arıtma Sistemleri
Arsenik Arıtma Sistemleri Biyolojik Arıtım Sistemleri
Biyolojik Arıtım Sistemleri Elektrodeiyonizasyon Sistemleri
Elektrodeiyonizasyon Sistemleri Endüstriyel Ekipmanlar
Endüstriyel Ekipmanlar Gri Su Arıtma Sistemleri
Gri Su Arıtma Sistemleri MBR Arıtım Sistemleri
MBR Arıtım Sistemleri Ultrafiltrasyon Sistemleri
Ultrafiltrasyon Sistemleri