Blog
pH Nedir? Suyun pH Değeri Kaç Olmalı 8.5pH

İçtiğimiz sudan kozmetik ve temizlik ürünlerinin içeriğine kadar sürekli dile getirilen pH tam olarak nedir hiç düşündünüz mü? Ya da yüksek ya da düşük pH değerlerinin vücudumuza etkileri nelerdir?
pH Nedir?
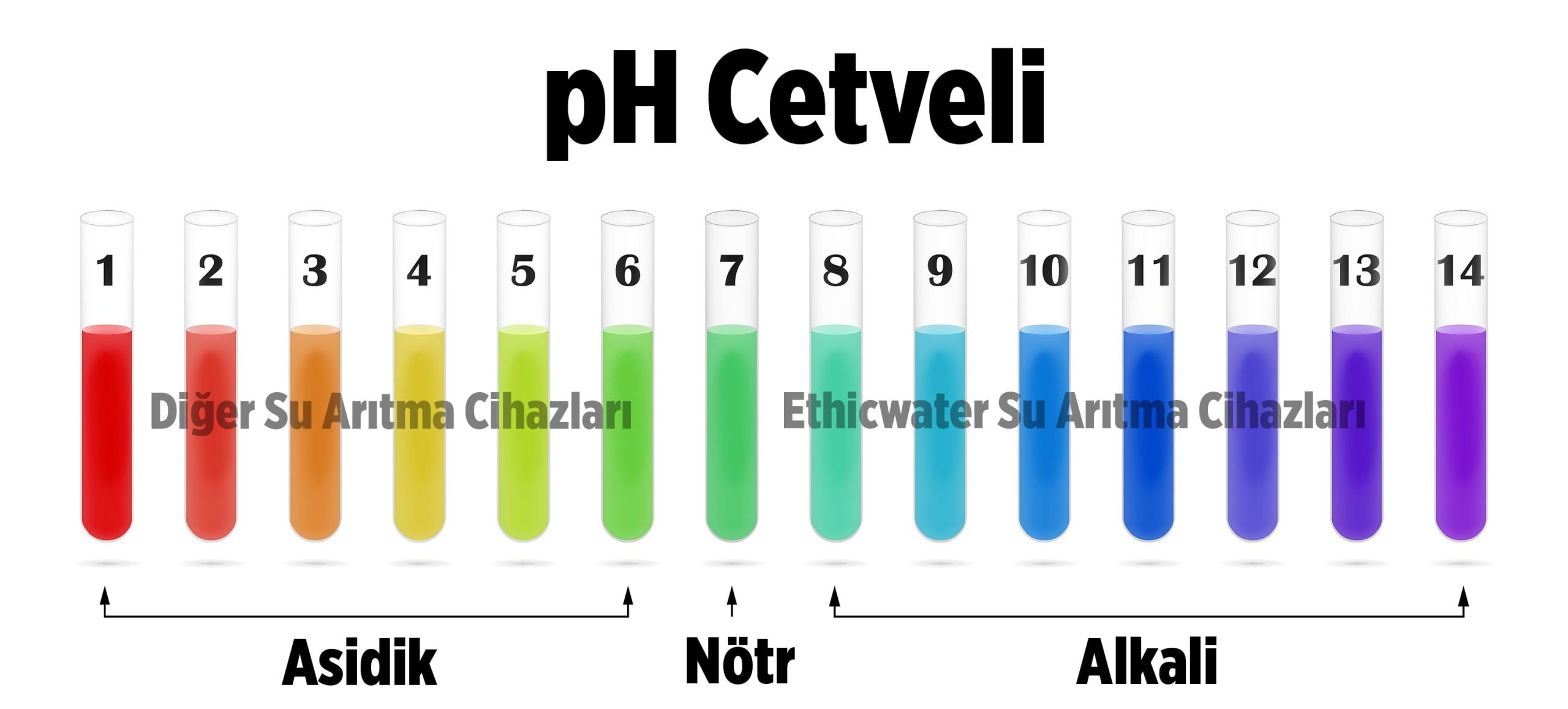
Bir maddenin asit veya alkali değerini anlamak için kullandığımız ölçüye pH (potansiyel hidrojen) denir. Maddenin içindeki asit nitelikli hidrojen iyonlarının yoğunluğuna göre ölçüm yapılır. pH cetveli 0 – 14 arasıdır. 0 aşırı asit, 14 de aşırı alkali demektir. 7 pH derecesi ise ne asit ne alkali yani maddenin nötr olduğunu gösterir.
Organlarımızın pH dereceleri küçük farklılıklar gösterse de bedenimiz için ideal ortam hafif alkali olandır. Kanı doğru bir pH derecesinde tutmak bedenimizin en önemli görevidir. Çünkü ufak sapmaların bile sağlığımız üzerinde büyük etkileri olur.
Modern yaşamda sürekli asit oluşturan etkilere maruz kalırız. Metabolizmanın kendi sağlığı asit miktarını çevremizdeki kirlilik ve kimyasallar da bedenimizde asit oluşumunu artırır. Kanın pH derecesini sağlıklı tutmak için yani 7.35-7.45 arasında tutmak için bedenimiz çeşitli yöntemlere başvurur.
Kemikler, kalsiyum gibi alkali minerallerin kana karışmasını sağlayarak yüksek proteinin neden olduğu asitli atıkları dengelemeye çalışır. Asitli atıklar böbreklerimiz ve idrar yoluyla bedenden atılırlar.
Akciğerlerimiz nefes yoluyla alkali olan oksijeni alıp asit olan karbondioksiti verir. Bedenimiz asit artışını oksijen azlığı olarak algılar. Örneğin yoğun egzersiz yaptığımızda bedenimiz, dokularda oluşan laktik asit birikimini dengeleyip pH derecesini korumak için nefes alışımızı hızlandırır ve yüksek oksijen girdisi sağlar. Nefes alışımız aşırı asit oluşturan bir yemek yediğimizde de hızlanır.
Asit birikimi hastalanmayı kolaylaştırır. Candida gibi mantarlar düşük pH derecesinde ürer. Egzama ve sedef hastalığı gibi iltihaplı hastalıklar da asitli ortamları sever. Habis kanser hücreleri de anaerobik yani oksijensiz ortamlarda türer. Bu gibi durumlarda vücut çeşitli salgılar ile alkali dengesini korumaya çalışır.
Peki, doğru pH için siz ne yapabilirsiniz?
Asit ortamını dengelemek için yaşamınızda %75 oranında alkali içeren yiyecekler ve alkali ortamı destekleyen etkinlikler ekleyin. Böylece daha kolay sakinleşebildiğinizi; duygularınızdaki ani iniş çıkışların dengelendiğini göreceksiniz.
Alkali su tüketerek ağrılarınız ve diğer sağlık sorunlarınızın yok olmaya başladığını fark edeceksiniz.
Özetle bedeninizin kendini iyileştirebileceği bir ortam yaratmak için alkali su ve besinleri hayatınıza alın ve bunun size olumlu geri dönüşünü izleyin.
Alkali Su İçmek Nedir? Ne Değildir? Su pH değeri?
Sağlıklı beslenme trendlerinin sıkı sıkıya takip edildiği son yıllarda su tüketiminin önemi de tüm uzmanlar tarafından altı çizilerek dile getirilmeye başladı. Özellikle bu gelişmelerden sonra yaşamın temel kaynaklarından biri olan su tüketimi konusundaki farkındalık ise değimlerimizde vurguladığımız “su gibi aziz ol” çizgisinden çıkarak daha bilimsel veriler ile eşleşmeye başladı. Artık hepimiz hangi saatlerde su tüketmemiz gerektiğini, günde kaç litre olması gerektiğini konuşuyor ve uygulamaya çalışıyoruz. Kullandığımız içme sularının etiketlerine göz atıp, önerilen değerler sahip olup olmadığını kontrol ediyoruz.
Çünkü artık suyu “içimin yangını sönsün” diyerek değil, hücrelerde elektriksel ve manyetik enerji üretimi sağladığını bilerek içiyoruz. Bütün bunların içinde kulağımıza çalınan konulardan biri de “alkali su” meselesi kimi fazla kilolara çare derken öteki kemik erimesinin ilacı diyor. Hepsinin de haklı olduğunu söylemek mümkün. Alkali su bir diğer adıyla bazik su, kalsiyum, silika, potasyum, magnezyum ve bikarbonat gibi mineraller açısından zengin olan su çeşididir. Vücut hücreleri tarafından daha iyi emilmeleri sebebi ile daha besleyici bir yapıdadırlar. İşte tam da bu yüzden vücudumuza olan faydası birden fazladır. Neler mi? Haydi birlikte inceleyelim!

Neden Alkali Au İçmeliyiz?
Güçlü bir antioksidan olan alkali su serbest radikallere karşı vücudu korur. Hem yaşlanma etkilerini hem de hastalıklara yakalanma riskini minimuma indirir. Nezle, grip gibi basit enfeksiyon hastalıklarından, kanser hücrelerinin oluşumuna kadar engelleyen alkali su, kalın bağırsakta biriken toksin atıkların temizlenmesinde de önemli bir rol oynar. Vücut sistemlerini düzenler.
Vücudumuzun pH değerine yakın olan su, alkali sudur. Hücrelerde manyetik enerji üretimi alkali su sayesinde gerçekleşir. Yani yağ hücrelerimiz kolayca enerjiye dönüşür, organlarımız daha rahat ve verimli çalışır. Daha fazla enerji ile günlük hayatın meydan okumalarına rahatlıkla cevap verebildiğimiz gibi daha fazla yağ yakar, daha fit ve sağlıklı gözükürüz.
Kanımız asitleştiğinde vücut pH’ı dengelemek için diş ve kemiklerimizi kalsiyum kaynağı olarak görmeye başlar. Erken yaşlarda “ay benim kemiklerim çok ince, çok narin” dediğimiz şey ilerleyen yaşlarda kemik erimesi olarak karşımıza çıkar. Kalsiyum takviyeleri ise kemik erimesini önlemede tam olarak yardımcı olamazlar. İşte bu karanlık tabloyu hayatınızda görmek istemiyorsanız çözüm çok basit, uzun süre ve düzenli olarak alkali su içmek. Böylece vücuttaki kemik erimesi ve böbrek taşı gibi asidik atıkların yavaş yavaş atar. 80’li yaşlarınızda torununuzla bilek güreşi yapmaya devam edebilirsiniz.
Pankreastaki hücrelerin vücut için yeterli insülin üretmemesinden kaynaklanan ikinci tip diyabet genellikle 40 yaşının üstündeki kişileri etkilemektedir. İnsülin üretemeyen bünye ise mutluluğu illa ki yabancı bir glikozun kollarında arar. Gel zaman, git zaman o kurabiyeler, o çikolatalar pankreasta kalıcı izler bırakır. Yetmezmiş gibi kalp damarlarınızı tıkatır. Alkali su, içerdiği kalsiyum iyonlarıyla aşırı protein oluşumunu engeller ve hem pankreasınızın hem de kalp damarlarınızın bu durumu atlatması için en büyük destekçisi olur.
Vücudumuza sayısız fayda sağlayan alkali su iç güzelliğimiz kadar dış güzelliğimize de katkı sağlar. Antioksidan içeren yapısı ile ödem atmamızı sağlarken, mineral dengesi ile vücudumuzun nem dengesini korumaya yardımcı olur. Cilt elastikiyetini muhafaza ettiği sürece ne sarkma ne kırışık emaresi göstermez. Düzenli diyet ve sporla yağ yakımını hızlandırması da cabası

OKUL DÖNEMİNDEKİ ÇOCUKLARDA SU TÜKETİMİ ÖNEMLİ!
Çocuklar için yaz, kış, soğuk, sıcak fark eder mi? İllaki koşulacak, illaki oyunlar oynanacak. Eğlence de neşe de hiç bitmeyecek. Hele de okulun yoğun temposundaki molalar da… Peki, o terlemeyle kaybedilen mineraller nasıl telafi edilecek?
Okullarda yapılan ders içi ve ders dışı etkinliklerin tamam mı hele de yaz aylarında çocuklarımızda aşırı terlemeye sebep olur. Bu nedenle sıcak havada egzersiz yapan çocuklarda yapılan gözlemlerde, sıklıkla sıvı kaybı (dehidratasyon) görülmektedir. Dehidrasyon yaşayan çocukların vücut ısılarının yetişkinlere oranla daha hızlı yükseldiği de bu alanda yapılan araştırmaların önemli bir sonucudur. Sonuç olarak çocuklarda yeterli su alımı çok önemlidir. Vücudun kaybettiği sıvı miktarını yerine koymak için çocuğunuza susamasa da su içirmeli, özellikle doğal mineralli ve pH değeri yüksek alkali suları tercih etmelisiniz.
Neden alkali su?
Güçlü Kemikler ve Sağlıklı Gelişim Desek…
Çocuklarda 1 yaşından itibaren su dengesi değişmeye başlar. Çocukluk ve ergenlik döneminde vücuttaki su oranı yavaş yavaş azalır. Yüksek miktarda kalsiyum içeren alkali sular, kemik gelişimi ve gelişme çağındaki çocukların boylarının uzamasında oldukça önemli bir rol oynamaktadır. Kalsiyumu en çok taşıyan yiyecekler süt, peynir ve yoğurttur. Bunun yanında kalsiyum oranı yüksek doğal mineralli su tüketimi de çocuklarınızın kemik gelişimine büyük oranda katkısı vardır.

Peki, Su İçme Alışkanlığını Nasıl Kazandıracağız?
Çocuklar daima büyüklerini taklit ederler. Tabi ki su tüketimi konusunda öncelikle onlara iyi birer örnek olmak şart… Bunun dışında yapılabilecek şeyler ise oldukça basit. Mutlaka okul çantalarına pH değeri yüksek, güvenilir bir markadan alınmış su şişesi koyun. Bu ona su içmesi gerektiğini sürekli hatırlatacaktır. Bu yöntem işe yaramıyorsa su şişesine keçeli kalemle hedefler koyun ve su içme işlemini oyunlaştırın. Böylece hem su tükettiğinden emin olur hem de bunu yaparken eğlenmesini sağlarsınız.
Neden pH Değeri Yüksek Alkali Su?
Yüksek pH değerine sahip alkali su, kalsiyum, magnezyum gibi birçok doğal mineral içerir. Doğal mineral içeren sular vücudun gün boyunca kaybettiği minerallerin bir kısmını geri kazanmasını sağlar. Kalsiyum, kemik sağlığı için büyük önem taşırken, pH’ı 7’nin üzerinde olan suların içinde aynı zamanda doğal oksijen iyonu da daha fazladır. Oksijen ise tüm metabolik faaliyetleri düzenleyen başlıca faktörlerden biridir. Alkali su ile hem çocuklarınızın kemik gelişimini hem de metabolik düzenini sağlayabilir, bağışıklık sistemi güçlü ve sağlıklı olduklarından emin olabilirsiniz.
pH değeri herhangi bir çözeltinin asitlik veya bazlık durumunu ifade eden ölçü birimidir. Çözeltilerin pH değeri 0 ile 14 arası değişmektedir. 0 – 7 arası asidik, 7- 14 arası ise bazik çözelti anlamına gelmekte olup, 7 nötrdür.
Suyun pH derecesi de 0’dan 14’e kadar olan değerleri almaktadır. 0 – 7 arası asidik, 7 nötr ve 7 – 14 arası alkali su olarak adlandırılmaktadır. Saf suyun pH derecesi 7’dir. Suyun asidik özellik göstermesi içeriğinde fazladan karbondioksit bulunması, alkali özelliği göstermesi ise fazladan kalsiyum bikarbonat ve alkali tuzları içerdiği anlamına gelmektedir. Ayrıca içeriğinde potasyum, kalsiyum ve magnezyum bulunması suyun asitlik derecesini düşürmektedir. Hafif alkali sular, insan sağlığı açısından daha verimli ve faydalıdır.

Doğada bulunan kaynak sularının pH değerleri içerdikleri maddelere göre oldukça farklılık göstermektedir. Suyun pH derecesi içerdiği hidrojen iyonu değişimine bağlıdır. Hidrojen iyonu değişiminin on kat değişmesi, pH değerinin bir birimlik değişimine karşılık gelir. Hem doğal kaynaklarda hem de içme sularında suyun pH değeri hafif alkali veya nötr olmalıdır. Özel olarak, kaynak sularında en uygun pH değeri 6,5 ile 8,5 arası, içme sularında ise 6,5 ve 9,2 arası olmalıdır.
Doğal kaynak suları için yasal düzenleme gereği kullanım izin aralığı 4,5 ile 9,5 arası olarak belirlenmiştir.
İdeal suyun pH değerinin yanında sertlik derecesi de sağlık açısından oldukça önemlidir. Sertlik derecesi suyun içeriğinde bulunan magnezyum ve kalsiyum miktarlarının toplamıdır. Az miktarda kalsiyum ve magnezyum içeren sular yumuşak olarak tanımlanır ve içimi oldukça iyidir. Fakat, vücuda yeteri miktarda mineral alınmamasına sebep olur. Türkiye’de kullanılan içme sularının sertlik dereceleri genel olarak azdır. Suyun sertlik derecesi gibi suyun pH değeri de kalsiyum ve magnezyum değerlerine bağlıdır.
Avrupa Birliği, içme suyu için 15 (FS) sertlik derecesini, Dünya Sağlık Örgütü ise 10 (FS) sertlik derecesini tavsiye etmektedir. En ideal içme suyu pH değeri ise 7,5 ve 8,5 arasıdır.
pH Ölçümü
pH bir çözeltinin asitlik veya alkalinlik derecesini tarif eden ölçü birimidir.
0’dan 14’e kadar olan bir skalada ölçülür. pH teriminde p; eksi logaritmanın matematiksel sembolünden, ve H ise Hidrojenin kimyasal formülünden türetilmişlerdir.
pH tanımı Hidrojen konsantrasyonunun eksi logaritması olarak verilebilir: pH = -log[H+]
pH hidrojen iyonun aktivitesi cinsinden bir asit veya bazın derecesini ifade etme yoluyla ihtiyaç duyulan kantitatif bilgiyi sağlar.
Bir maddenin pH değeri hidrojen iyonu [H+] ile hidroksil iyonunun [OH–] değişimlerinin oranına direk bağlıdır. Eğer H+ değişimi OH– değişiminden fazla ise maddemiz asidik; yani pH değeri 7’den düşüktür. Eğer OH– derişimi H+ değişiminden fazla ise maddemiz bazik; yani pH değeri 7’den büyüktür. Eğer OH- ve H+ iyonlarından eşit miktarlarda mevcut ise, madde 7 pH değerine sahip olmak üzere nötraldir.
Asit ve bazlar her biri serbest hidrojen ve hidroksil iyonlarına sahiptirler. Belli koşullarda ve belli bir çözeltide hidrojen ve hidroksil iyonlarının ilişkileri sabit olduğu için, birini tespit etmek diğerini bilmek ile mümkündür. Bu anlamda, pH, tanımsal açıdan hidrojen iyonu aktivitesinin seçici bir ölçümü olsa da hem alkalinlik hem de asitliğin bir ölçüsüdür. pH logaritmik bir fonksiyon olması açısından, pH değerindeki bir birimlik değişim hidrojen iyon değişimindeki on-katlık değişime karşılık gelir.
MOLAR KAVRAMI
Bir bileşiğin molü moleküllerin Avogadro sayısı (6.02 x 1023 molekül) olarak tanımlanır. Kütlesi ise yaklaşık olarak gram cinsinden moleküler ağırlığa eşittir.
Örneğin, sodyum hidroksit, NaOH için, moleküler ağırlık 23+16+1 = 40 olup, bir molünde 40 gram mevcuttur. Hidrojen [H+] iyonunun atomik ağırlığı bir (1) olduğuna göre, bir mol hidrojende 1 gram hidrojen iyonu mevcuttur. pH’ı 10 olan bir çözeltide 1 x 10-10 mol hidrojen iyonu, veya bir litre çözeltide 10-10 gram vardır.

İYONLAŞMA
İyon yüklü bir parçacık olup elektron (lar) kazanmış veya kaybetmiş bir atom veya molekül tarafından yaratılır. Çözeltide iyonların varlığı, içinden bir iletken gibi elektriksel enerjinin geçirilmesine olanak verir. Farklı bileşikler, atomların elektron kaybedip kazanma kabiliyetine bağlı olarak çözeltilerde farklı miktarlarda iyonlar oluşturur. Çözeltide hidrojen (H+) veya hidroksil (OH–) iyonlarını oluşturma amacıyla bağlarını çözerler (veya iyonize olurlar).
Bağlarını kolayca ayıran moleküller su çözeltisinde iken kuvvetli asit veya bazlar oluşturacaktır. Bunlara örnek hidroklorik asit (HCl) ve sodyum hidroksittir (NaOH):
HCl +H2O —> H3O + Cl
NaOH —> Na+ + OH–
Sulu bir çözeltide, hidrojen iyonları normalde çözücü olan su ile birleşerek hidronyum iyonunu (H3O+) oluşturur. Bu cins çözeltilerin ölçümleri bu bakımdan hidronyum iyonu konsantrasyonu ölçümleridir. Genellikle pH ölçümü ile ilgili uygulamalarda “hidronyum iyonu” ve “hidrojen iyonu” birbirleri ile değişmeli olarak kullanılırlar.
Bazı bileşikler zayıf asit ve bazlar oluştururlar; bileşiklerin sadece çok az bir yüzdesi kendilerini oluşturan iyonlara ayrışırlar, böylelikle çok az hidrojen veya hidroksil iyonu oluşur. Buna bir örnek, her 100 molekül başına bir adetten daha az hidrojen iyonundan daha az oluştuğu, asetik asittir.
H2O + CH3COOH—> H3O+ + CH3COO–
Saf su da 25°C da her bir su molekülü başına 10-7 hidrojen ve 10-7 hidroksil iyonu olmak üzere zayıfça ayrışır.
2H2O—> H3O+ + OH–
Suya asidin ilavesi hidrojen iyon konsantrasyonunu arttırırken hidroksil iyon konsantrasyonunu azaltır. Suya ilave edilen bir baz ters etki yapar. Hidroksil iyonlarının konsantrasyonu artar ve hidrojen iyonlarının konsantrasyonu düşer.
H2O + HCl—–> H3O+ + Cl–
H2O + NaOH—-> Na+ + H2O + OH–
pH ölçümünün çok geniş kullanım alanları vardır. Örneğin, pH ölçüm ve kontrolü içme suyunun saflaştırılmasında, şeker üretiminde, atık maddelerin işlenmesinde, gıda proseslerinde, elektro kaplama da ve kozmetik maddeler ile ilaçların başarılı etkinliği ve güvenliğinin temininde anahtar rol oynar. Bitkilerin düzgün gelişebilmesi için toprağın belli pH aralığında olması gerekir, hayvanların kan pH’ı doğru sınırlar dahilinde değil ise hastalanabilir veya ölebilirler.
pH Ölçümü Nasıl Yapılır?
Yaklaşık bir pH belirlemesi, pH seviyesi değiştikçe değişik renk alan pH kağıtları veya göstergeleri ile elde edilebilir. Bu tip göstergelerin doğruluklarında sınırlamalar mevcuttur ve renkli veya koyu örneklerde doğru olarak sonuç elde etmek zorlaşabilir.
Daha doğru pH ölçümleri bir pH metre ile elde edilebilir. pH ölçümü üç parçadan oluşur: pH ölçüm elektrotu, referans elektrotu ve yüksek empedans girişli bir cihaz. pH elektrotu, ölçülen çözeltinin pH’ına göre voltaj veren bir pil gibi düşünülebilir. pH ölçüm elektrotu hidrojen iyonuna hassas bir cam haznedir. Haznenin içinde ve dışındaki bağıl hidrojen konsantrasyon değişimine göre farklı mili volt çıkışı verir.
Referans elektrotu çıkışı hidrojen iyonu aktivitesi ile değişmez. pH elektrotunun iç direnci çok yüksektir. pH değişimine göre ortaya çıkan voltaj değişimini ölçmede zorluk çıkarır. pH metrenin giriş empedansı ve kaçak dirençler önemli faktörler haline gelir. pH metre temel olarak yüksek empedanslı bir yükseltici olup anlık elektrot voltajlarını ölçüp sonuçları analog veya dijital bir göstergede pH birimi cinsinden gösterir. Bazı hallerde, özel kullanım alanları veya iyon-seçici ya da Oksidasyon-İndirgeme Potansiyeli (ORP) elektrotlar için voltaj da okunabilir.

SICAKLIK KOMPANZASYONU (DENGELEMESİ)
Sıcaklık Kompanzasyonu cihaz içine alınmaktadır. Çünkü pH ölçümü ve elektrodları sıcaklığa karşı hassastır. Sıcaklık kompanzasyonu manuel veya otomatik olabilir. Manuel kompanzasyonda, ayrı bir sıcaklık ölçümü gereklidir ve pH metrenin manuel kompanzasyon kontrolü yaklaşık sıcaklık değerine göre ayarlanır. Otomatik sıcaklık kompanzasyonunda (ATC), kendi başına çalışan bir sıcaklık probundan gelen sinyal pH metreye beslenir, böylece numunenin pH değeri doğru olarak o sıcaklıkta belirlenir.
TAMPON ÇÖZELTİLER
Tamponlar pH değerleri sabit olan ve o pH seviyesinde değişimlere dirençli duran çözeltilerdir. pH ölçüm sistemini ( pH metre ve elektrodu) kalibre etmede kullanılırlar.
Zaman geçtikçe bir elektrodun bir diğerinden çıkış bakımından ufak farkları olabilir. Sistem bu bakımdan periyodik olarak kalibre edilmelidir. Tamponlar geniş bir pH değer aralığında mevcuttur. Hem hazır karışmış sıvı olarak hem de toz kapsül biçimde temin edilirler. Çoğu pH metre birkaç spesifik pH değerinde kalibre edilmelidirler. İlk kalibrasyon genellikle izopotansiyel nokta ( pH 7 de ve 25°C’da elektrodun verdiği sinyal 0mV’dur) civarında yapılmalıdır, ve bir ikincisi de ya pH4 ya da pH10’da yapılmalıdır. Ölçümü yapılacak numunenin fiili pH değerine mümkün olan en yakın tamponu seçmek en iyisi olacaktır.
SICAKLIK ETKİLERİ
pH elektrodu sıcaklığa bağlıdır, ve pH metre devresinde dengelenir. pH metre devre sistemi, pH elektrodunun genel bir matematiksel tanımı olan, Nernst denkleminden faydalanır.
E = Ex + {2.3RTK / nF} log (ai)
Burada:
Ex= referans elektroduna bağlı olan sabit
R= sabit
TK = mutlak sıcaklık (Kelvin)
n= iyonun yükü ( işareti dahil olmak üzere)
F= sabit
Ai= iyon aktivitesi
pH ölçümünde bizi ilgilendiren hidrojen iyonundaki H+ olup:
{2.3RTK / nF} = 59.16 mV
Burada: n = 1 ve T = 25°C’dır. Bu terime Nernst katsayısı adı verilir.
pH, hidrojen ion etkinliği logaritmasının eksi değeri olarak belirlenmiş olduğundan, her hangi bir sıcaklık da genel denklem şöylece ifade edilebilir:
E = Ex – 1.98 Tk pH
Çözeltideki sıcaklık değişmeleri, Nernst denklemine uygun olarak cam pH elektrodunun milivolt değerini değiştirecektir. Sıcaklığa karşı elektrod hassasiyetindeki değişimler doğrusal bir fonksiyon olup pek çok pH metre bu dengelemeyi sağlamak üzere gerekli akım tasarımı ile teçhiz edilmiştir. Şekil 2 farklı sıcaklıkların, cam pH elektrodunun sinyalleri üzerindeki etkisini göstermektedir.
Şekil.2 bu üç eğimin, 0 mV ve pH 7 durumundaki noktada kesiştiğini göstermektedir; bu izopotansiyel noktada temperaturla ilgili olarak milivolt değişikliği olmadığı anlamı çıkar. Aynı zamanda, pH 7 civarında ölçüm çalışması yapıldığı vakit, temperatur dengelemesinin belirgin bir faktör olmadığı görülür. Bununla beraber, pH 3.0 veya 11.0 düzeylerinde bir ölçüm çalışması yapıldığı vakit, 15°C lik bir sıcaklık değişikliği 0.2 pH hatasına yol açabilir. Elektrod üzerinde sıcaklık etkisinin doğrusal olduğu gösterilmiş olduğu için, pH üzerinde sıcaklık bağımlılığı şöylece ifade edilebilir:
0,03 pH hatası / pH birim başına / 10°C
Numunenin gerçek pH’ı, çözeltinin hidrojen iyon aktivitesinde (etkinliğinde) olan değişikliklerden dolayı ve çözeltinin sıcaklığına bağlı olarak gerek bileşiğin iyonlanması ve gerekse çözeltideki hidrojen iyon etkinliğinin sıcaklığa bağımlı olmasından dolayı değişebilmektedir. Doğru bir pH ölçümünün istenilen sıcaklık da yapılması gerektiği için dengeleme mekanizması bu düzeltmeyi esasen yapmaz, zaten bunu yapması da istenmez. Sıcaklık dengelemesi, gerçek çözeltinin pH’ın da ki değişiklik için değil, yalnızca elektrodun çıkışı için bir düzeltme yapar.
Sıcaklık cam membranın (zarın) empedansına da etki yapar. 25°C’nin altında, her 8°C için belirlenmiş olan empedans iki kat bir değere çıkar. Camın cıdarının orijinal empedansına bağlı olarak, ölçüm aparatının düşük sıcaklıklarda ölçüm yapacak ise daha yüksek empedansa sahip olması gerekmektedir.
| 0°C | 25°C | 100°C | |
| 0 | 375 | 410 | 540 |
| 1 | 321 | 351 | 463 |
| 2 | 268 | 293 | 386 |
| 3 | 214 | 234 | 309 |
| 4 | 161 | 176 | 231 |
| 5 | 107 | 117 | 154 |
| 6 | 54 | 59 | 77 |
| 7 | 0 | 0 | 0 |
| 8 | (54) | (59) | (77) |
| 9 | (107) | (117) | (154) |
| 10 | (161) | (176) | (231) |
| 11 | (214) | (234) | (309) |
| 12 | (268) | (293) | (386) |
| 13 | (321) | (351) | (463) |
| 14 | (375) | (410) | (540) |
Şekil. 2
Hakkında Ethic Water
Ethic Water, su arıtma teknolojileri alanında yıllara dayanan tecrübesiyle hizmet veren güvenilir ve uzman bir firmadır. Temiz ve sağlıklı suya erişimi herkes için mümkün kılma misyonuyla yola çıkan Ethic Water; su arıtma cihazları, içme suyu kalitesi ve suyun insan sağlığı üzerindeki etkileri hakkında güncel ve bilimsel içerikler üretmektedir. Yayınladığı blog yazılarında, hakemli akademik dergilerde yayımlanmış bilimsel çalışmalardan alıntılar ve güncel literatür taramaları kullanarak bilgi sunmaya özen gösterir. Profesyonel teknik kadrosu ve etik hizmet anlayışıyla müşterilerine sürdürülebilir çözümler sunan Ethic Water, suyun yaşam için taşıdığı önemi anlatan bilgilendirici blog yazılarıyla da fark yaratmayı hedeflemektedir.
Ethic Water tarafından yazılan tüm gönderileri görüntüleYasal Uyarı ve Sorumluluk Reddi: Bu blogda yer alan tüm içerikler yalnızca genel bilgilendirme amaçlıdır ve yayınlandığı tarihteki mevcut bilimsel verilere dayanarak hazırlanmıştır. Söz konusu bilgiler, profesyonel tıbbi tavsiye, teşhis veya tedavi yerine geçmez. Sağlığınızla ilgili herhangi bir soru, endişe veya ihtiyaç durumunda, lütfen bir doktora ya da yetkin bir sağlık kuruluşuna başvurunuz. Bu blogda sunulan bilgilerin kullanımı tamamen okuyucunun sorumluluğundadır. Blog sahibi, yazarlar veya bağlı kuruluşlar, bu içeriklerin doğruluğu, güncelliği veya eksiksizliği konusunda herhangi bir garanti vermez ve bu bilgilerin kullanımından kaynaklanabilecek doğrudan veya dolaylı herhangi bir zarar veya kayıptan sorumlu tutulamaz. Sağlık durumunuza ilişkin kararlar almadan önce, mutlaka bir sağlık uzmanına danışmanız gerektiğini unutmayınız. Bu blog, tıbbi bir hizmet sunmamakta olup yalnızca bilgilendirme amacı taşımaktadır.


 Housing Filtre Setleri
Housing Filtre Setleri Arıtma Cihazı Filtre Setleri
Arıtma Cihazı Filtre Setleri Duş Filtreleri
Duş Filtreleri Housing Filtreler
Housing Filtreler Membran Filtreler
Membran Filtreler UV Filtreler
UV Filtreler Yıkanabilir Filtreler
Yıkanabilir Filtreler Analiz Cihazları
Analiz Cihazları Basınç Ayarlayıcılar
Basınç Ayarlayıcılar Çekvalfler
Çekvalfler Clipsler
Clipsler Fittingsler
Fittingsler Hortum
Hortum Housing Anahtarları
Housing Anahtarları Housingler
Housingler Musluk
Musluk Pompa
Pompa Su Analiz Kitleri ve Cihazları
Su Analiz Kitleri ve Cihazları Switchler & Solenoid Valfler
Switchler & Solenoid Valfler Tank
Tank Valfler
Valfler Aktif Karbon Filtreleri
Aktif Karbon Filtreleri Arsenik Arıtma Sistemleri
Arsenik Arıtma Sistemleri Biyolojik Arıtım Sistemleri
Biyolojik Arıtım Sistemleri Elektrodeiyonizasyon Sistemleri
Elektrodeiyonizasyon Sistemleri Endüstriyel Ekipmanlar
Endüstriyel Ekipmanlar Gri Su Arıtma Sistemleri
Gri Su Arıtma Sistemleri MBR Arıtım Sistemleri
MBR Arıtım Sistemleri Ultrafiltrasyon Sistemleri
Ultrafiltrasyon Sistemleri
























“pH Nedir? Suyun pH Değeri Kaç Olmalı 8.5pH” ile ilgili yorumlar;